神经科学家经常研究神经电生理学——大脑内发生的神经元电活动——以更好地了解可能导致特定行为和大脑相关疾病的过程,如精神分裂症、阿尔茨海默病和帕金森氏病。
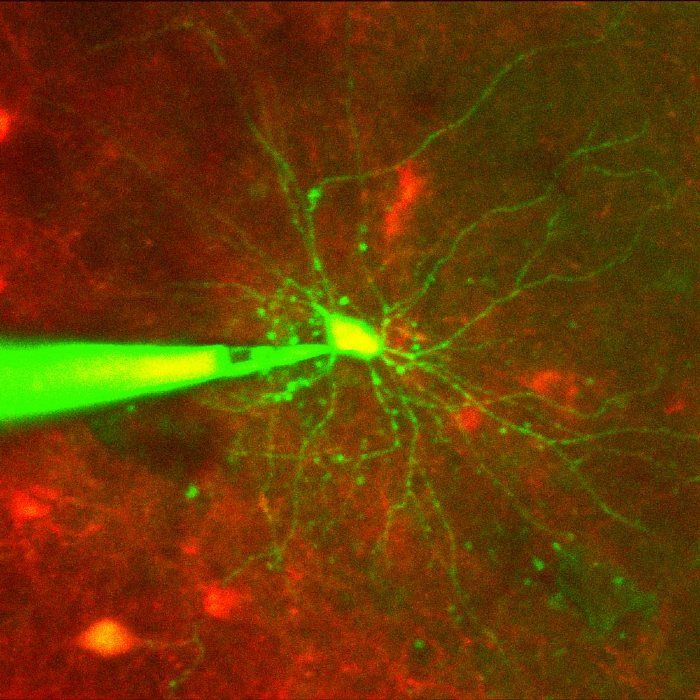
以细胞为目标的贴片钳是一种已被证实的测量单个神经元电活动的技术,但手动操作是极具挑战性的,特别是 在活的有机体内;它需要双光子显微镜和微操作器的同时操作来引导移液管与完整大脑中的目标细胞接触(细胞通常会随着移液管的移动而移动,因此,需要多次调整移液管的位置以补偿细胞的移动)和应用刚好足够的吸力来突破细胞膜(图1)。世界上为数不多的研究人员可以手动钳住靶向细胞 在体内 ,成功率约为20%。
在麻省理工学院媒体实验室和麦戈文研究所的爱德华·博伊登的研究小组工作时,我开发了一个系统,可以自动将细胞靶向的贴片夹紧 在活的有机体内这使得更多的神经科学家能够在他们的实验室中应用这项技术。作为MATLAB实现® 应用程序,我的Imagepatcher软件处理来自双光子显微镜的图像,向四轴微操作器发送指令,并通过控制电子压力调节器和阀门施加吸力。在活体老鼠的大脑中,Imagepatcher系统的最初实现表现得与经验丰富的神经科学家一样好,成功率达到或超过了他们。
手动夹片是如何工作的
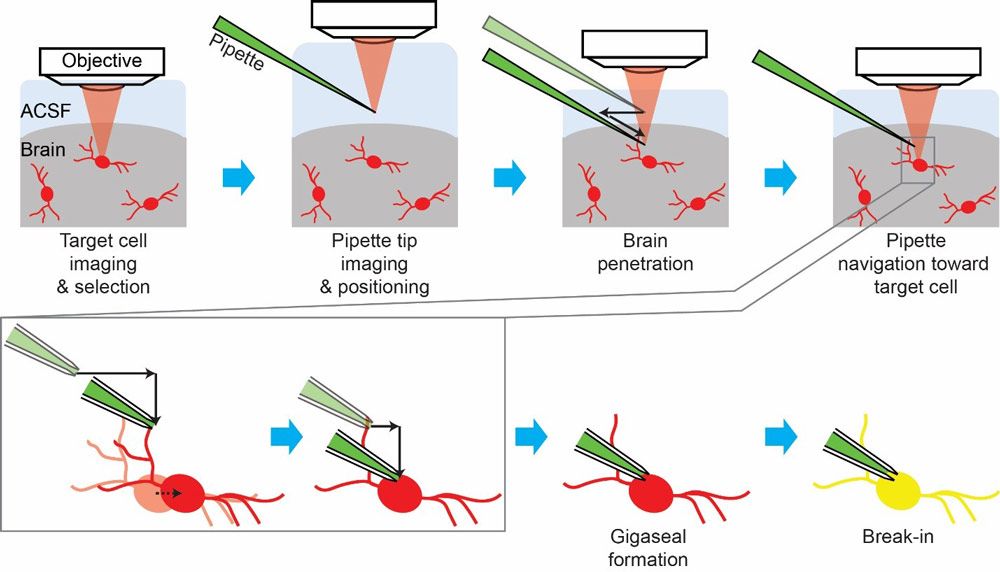
Cell-targeted patch-clamping是一个多级的过程当吸管的一角开始进入接触目标细胞(图2)。手动完成第一阶段,研究人员使用一个双光子显微镜来确定目标细胞显微操纵器来操纵吸管进入视野。研究人员一手操作显微镜,一手操作微操作器,逐步移动移液管尖端接近目标细胞,在移液管尖端接近细胞膜时小心地补偿细胞的移动,经过多轮显微镜聚焦和视野调整。
在移液管尖端测量到的电阻突然变化证实了移液管尖端与电池接触。此时,研究人员必须迅速将焦点从显微操作器转移到注射器上。注射器的尖端通过空心管连接到移液器的背面,用于对移液器施加吸力,帮助建立 gigaseal,尖端与与移液管尖端接触的那片细胞膜之间的紧密密封; giga 为大于1g ω(1 GΩ)的电阻。然后,研究人员应用一系列的吸力脉冲来实现 在,即细胞膜破裂,可以进入细胞内部。这个州被称为 全细胞配置它能够高质量地记录细胞的电活动。为了获得高质量的记录,研究人员必须在尽可能少的损伤细胞的情况下完成整个过程。
从MATLAB内部访问和控制实验室设备
为了自动化涉及贴片夹紧的众多手动操作,我需要MATLAB和所涉及的三个仪器之间的接口:显微镜的接口由 ScanImage提供,这是一个开源的显微镜控制软件包,由 维护Vidrio技术.我使用ScanImage对图像采集的各个方面进行控制,包括何时以及如何从显微镜中采集图像进行MATLAB处理。微操作器的接口由制造商(Sensapex)作为库提供。我使用这个库从MATLAB内以匀速控制移液管的运动。我使用国家仪器数据采集(DAQ)板和仪器控制工具箱™开发了调节器和阀门的接口。
实现Imagepatcher控制循环
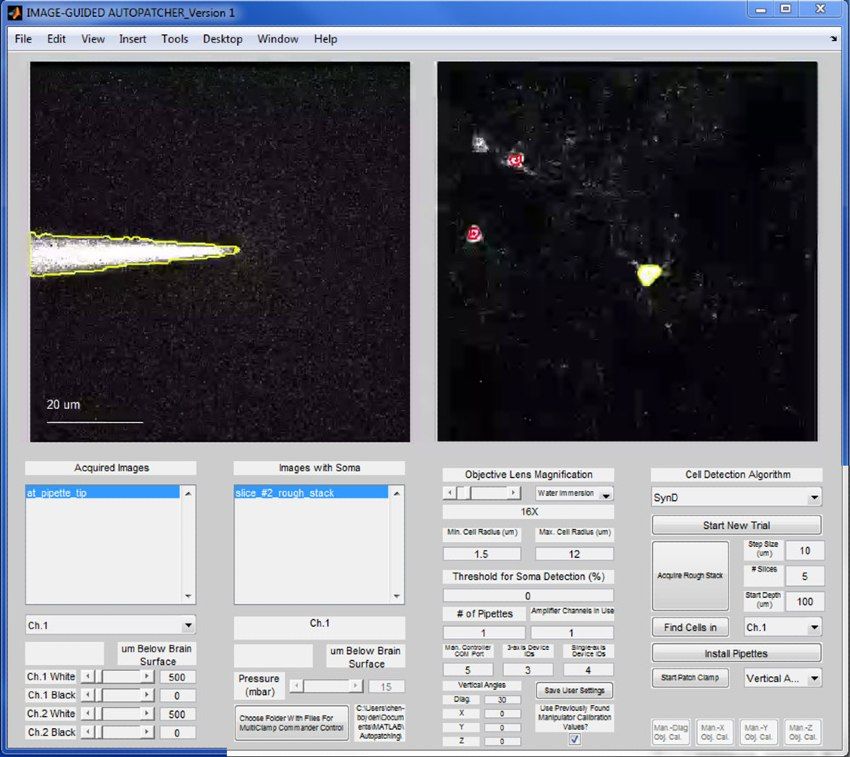
Imagepatcher软件包括三个主要的控制循环。每个循环在MATLAB中运行。第一个控制移液管的运动,直到它的尖端接触到目标神经元,第二个施加吸力形成一个gigaseal,第三个施加吸力脉冲来实现突破。在补丁夹紧过程中,Imagepatcher软件自动运行这些控制循环。一个基于MATLAB的接口使研究人员能够管理和监控过程(图4)。
第一个控制回路的算法从显微镜获取图像,分析它以识别细胞,计算细胞和移液管尖端之间的偏移量,并向微操作器发送命令将移液管移动到更靠近细胞的位置。这些步骤重复进行,直到移液管到达目标位置,在移液管尖端测量到电阻的突然变化。
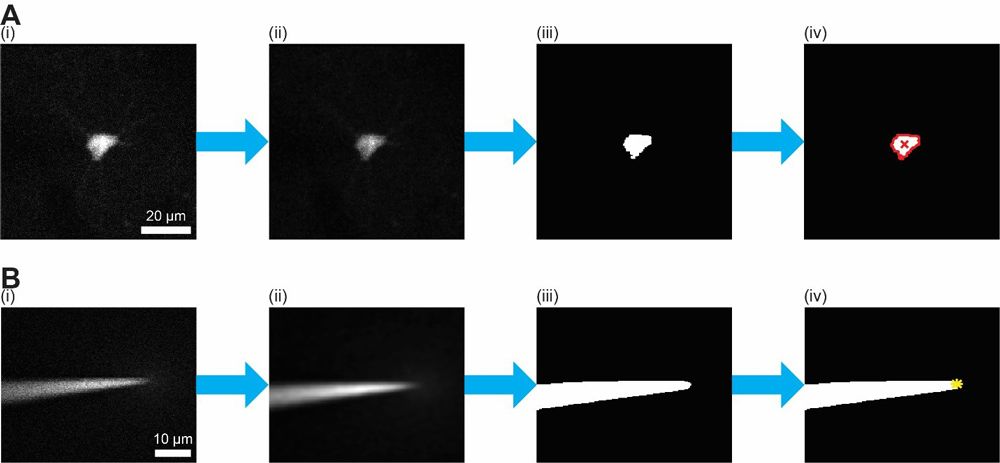
在这个循环中,我调用了图像处理函数来分析显微镜生成的图像。首先,我使用2D维纳滤波器来去除光子噪声,它在图像中以高强度散斑的形式出现。接下来,我应用阈值函数来产生分离荧光标记细胞的图像的二进制版本。然后对二进制图像执行形态操作,以确定 重心细胞的 ——细胞边界内我用移液管瞄准的点。在循环开始之前,我使用了一个类似的程序,在图像中分离移液管并识别其尖端(图5)。尖端的初始位置用于计算在循环中移液管运动后的尖端位置。该算法在三维空间中计算出细胞质心与移液管尖端之间的偏移量后,生成移动移液管所需的微操作器指令,并通过串行接口将指令发送给微操作器。
一旦移液管到达细胞,Imagepatcher就进入压力控制回路。在这里,算法通过使用MATLAB和数据采集工具箱™在移液管尖端产生压力,为设置的三个电子压力调节器产生模拟信号,为其四个电子阀门产生数字信号。该算法动态改变压力,直到在尖端测量的阻力达到1 GΩ。压力控制算法采用启发式,加快形成gigaseal-for示例中,如果测量电阻低于1 GΩ,缓慢上升,该算法显著增加吸入,而如果是稳步上升的阻力,它维护现有的压力和等待gigaseal形式。
第三个也是最后一个控制回路用于进入细胞膜。最初,Imagepatcher在获得gigaseal后自动启动这个循环,但同事们指出,一些研究人员更喜欢在闯入之前进行记录(即细胞连接的记录)。附在细胞上的记录不能提供与全细胞记录相同水平的信息(例如,阈下活动),但一些研究需要完整细胞的记录。为了满足这一需求,Imagepatcher被配置为在继续第三个控制循环之前暂停并等待操作员确认。
为了启动侵入,Imagepatcher施加一系列压力增加的吸力脉冲,同时再次监测在移液管尖端测量到的电阻。当细胞膜破裂时,测量到的电阻从超过1 GΩ降到几百兆欧。当进入成功后,Imagepatcher停止吸痰,研究人员可以开始记录。
最初的结果和计划的增强
Imagepatcher的第一个版本匹配或略高于经验丰富的研究人员报告的成功率,实现全细胞配置的时间约为20-22%。Imagepatcher完成一个贴片夹紧过程大约需要10分钟,这与那些研究人员所需要的时间相当。自动贴片夹紧后的记录长度(平均约15分钟)和质量与手动贴片夹紧程序后的记录相当,这表明Imagepatcher不会比手动贴片夹紧程序对细胞造成任何损害。最重要的是,Imagepatcher提供了手工方法无法比拟的一致性和一致性,使更多的研究人员能够可靠地执行过程。事实上,全球已有7个实验室对使用Imagepatcher表示了兴趣。
我计划实现增强功能,通过利用硬件的能力来执行无法手动执行的技术,例如精确应用吸入脉冲模式,从而提高Imagepatcher的速度和成功率。